1.ディープラーニングを使った網膜眼底画像からの屈折異常予測(1/3)まとめ
・網膜画像から屈折異常などを発見するためにディープラーニングが役に立つかを評価
・非常に高い精度で屈折異常を発見できる事と窩領域を人工知能が重視した事がわかった
・結論としてディープラーニングが医療用画像から新規予測を行うために適用できる
2.ディープラーニングを使った目の診断についての研究
以下、iovs.arvojournals.orgより「Deep Learning for Predicting Refractive Error From Retinal Fundus Images」の意訳、三部作です。第二部はこちら
概要
目的
網膜の眼底画像から屈折異常などの新規情報を抽出するために、どのくらいディープラーニングが役に立つかを評価します。
手法
この研究で使用された網膜眼底画像は、UK Biobank(英国Biobank)および年齢関連眼疾患研究(AREDS:Age-Related Eye Disease Study)臨床試験からの45度および30度からの視野画像です。屈折異常は、UK Biobankのautorefraction(自動収縮法)とAREDSのsubjective refraction(主観的屈折法)によって測定しました。我々は、合計226,870の画像を用いて屈折異常を予測するためのディープラーニングを訓練し、UK Biobankの24,007画像とAREDSの15,750の画像でそれを検証しています。我々のモデルでは「Attention」の手法を使用して、屈折異常と関連する特徴を識別しました。
結果
得られたアルゴリズムの平均絶対誤差(MAE)は
・UK Biobankデータセットでは0.56ジオプター(95%信頼区間:0.55-0.56
・AREDSデータセットでは0.91ジオプター(95%信頼区間:0.89-0.93)
でした。
注)ジオプター(屈折度)とは、近視や遠視、乱視の度数を表す単位。参考ページによれば軽度近視は大体-0.25ジオプター、裸眼視力で言えば1.2~0.8程度との事。95%信頼区間とは、データをランダムに100回選んでも、95回くらいは信頼区間内にデータが含まれる事を意味する数字。
予測ベースライン(この集団の平均を単に予測することによって得られる)は、UK Biobankでは1.81ジオプター(95%信頼区間:1.79-1.84)、AREDSでは1.63(95%信頼区間:1.60-1.67)となりました。
Attentionによるマップでは、他の領域も予測に寄与していますが、人口知能は窩領域をこの予測を行う際に最も重要視している事が示唆されています。
結論
我々の知る限りでは、網膜の眼底写真から高精度で屈折異常を推定する能力は以前には知られておらず、ディープラーニングが医療用画像から新規予測を行うために適用できることを実証しました。
矯正されていない屈折異常は、世界中の視力障害の中でも最も一般的な原因の1つです。眼の屈折異常はいくつかの要因によって決まります。眼の長さに関連する屈折異常である軸眼屈折異常は、球面屈折異常の主な原因であると考えられています。軸長が長すぎる光学系を有する眼は「近視眼」と見なされ、短すぎる眼は「遠視眼」として知られています。角膜の水晶体および湾曲は、眼の光学系と球面屈折誤差と眼の乱視特性の両方に寄与します。
屈折異常の蔓延、特に西洋人およびアジア人に近視眼鏡の異常が増えています。処方眼鏡またはコンタクトレンズで大部分は治療可能ですが、屈折矯正の影響を受けた人々の大多数は低所得国で生活しています。したがって、このような治療を受けていない可能性があります。
視力を測定するために眼底または画像を撮影するためのスマートフォン付属品などの新規かつポータブルな器具は、開発途上国の眼疾患をスクリーニングし診断する低コストの方法を提供します。そらは、糖尿病性網膜症および視神経の評価において有望ですが、画像を解釈するためには専門設備が必要になります。
人工知能(AI)は、医療用画像の診断および解釈において有望な結果を示しています。特に、ディープラーニングとして知られているAIの種類は、規則や特徴を明示的に指定しなくても、大量のラベル付き画像データセットから直接的に予測特徴を学習することを可能にします。最近の医療画像のディープラーニングアプリケーションは、メラノーマ、糖尿病性網膜症、および乳癌リンパ節転移を含む様々疾患を検出が可能であり、医療専門家の診断結果とそん色ない検出率を実現しています。
ディープラーニングは、年齢、性別、血圧、その他の心臓血管の健康に関わりのある因子を画像と共に入力として扱い、医学の専門家であっても画像単体からは抽出できないような疾病の兆しを察知することができます。
ディープラーニングによって生成される診断の精度は高いのですが、人工知能は数多くのデータを入力に用いるため、患者のどの特徴が人工知能によって重視されて最終的な診断になったのかを正確に理解することは困難です。
人工知能が重視している患者の特徴を、人間が解釈可能な形に割り出す事は、システムへの信頼性を高めるために重要であるだけでなく、病気の根本的なメカニズムを理解するためにターゲットを絞った仮説の生成を可能にします。
実際、眼の研究および臨床実習における以前の研究の多くは、精巧な推測および検査のプロセスに大きく依存していました。最初に、どの特徴が所望の結果を最も予測しているかの推測及び仮説を生成し、次にこれらの仮説に基づいて臨床試験していました。ディープラーニングを使えば、最初に人工知能に予測をさせ、人工知能が最も注目した部分に焦点を絞って仮説を組み立てる事ができます。
この研究では、2つの異なるデータセットを用いて、眼底画像から屈折異常を予測するためのディープニューラルネットワークを訓練しました。
屈折異常、特に軸眼屈折異常は、眼底の特徴的な変化に関連しており、これは、特に長軸方向の長さを有する近視眼において、研究されています。更にAttentionのテクニックを、人工知能が予測を行う際に重視した特徴を視覚化し、識別するために使いました。これは、屈折異常の病因に網膜のどの部分が関係しているのかを理解するために役立つかもしれません。
(1)具体的な手法
データセット
この研究では、UK BiobankとAREDSの2つのデータセットを使用しました。
英国Biobankのデータセットは、2006年から2010年にかけてイギリス全土で40歳から69歳までの50万人の参加者を募集している現在進行中の観察調査です。各参加者は生活習慣アンケートを記入し、一連の健康測定を行い、生物学的サンプルを提供し、健康診断の結果についての追跡調査に協力しています。
約7万人の被験者が、自動屈折装置(RC5000; Tomey Corp., Nagoya, Japan) を用いた屈折異常の評価、三次元OCT装置 (OCT-1000 Mark 2; Topcon Corp., Tokyo, Japan).を用いた非水晶体光干渉断層撮影(OCT)および45度網膜眼底撮像を含む眼科検査を受けました。
両眼白内障手術を含む眼科手術を受けた参加者は、眼の検査対象者から除外されました。これは、その主要な屈折異常状態を判定することができなかったためです。
AREDSは、加齢性黄斑変性症および白内障の自然経過および危険因子を調査した米国における臨床試験です。治験は1992年から1998年の間に参加者を登録し、11の網膜専門診療所で2001年まで臨床追跡を継続しました。この研究は、独立したデータおよび安全性監視委員会および各臨床センターの施設審査委員会によって承認されました。
参加者は55歳から80歳までの合計4757名で追跡された期間の中央値は6.5歳です。
眼科検査の一環として、参加者は最初、およびその後の訪問時に主観的屈折検査とカラー眼底撮影を受けました。
簡潔に述べると、屈折検査の手法には網膜鏡検査が含まれ、主観的屈折を用いてさらに精細化しています。読影所で承認された透明フィルムを用いて、眼底カメラ(Zeiss FFシリーズ; Carl Zeiss、Oberkochen、Germany)を用いて、30度視野のカラー眼底写真を取得した。この研究ではこの写真を使用しています。
球面等価(SE)として知られている屈折誤差の球相当部分は、球面屈折力+ 0.5 *円柱屈折力の公式を使用して計算できます。
SEは英国BiobankとAREDSの両方のデータセットで利用可能でしたが、球面屈折力と円柱屈折力はUK Biobankデータセットでのみ利用可能でした。各データセットは、開発セットと臨床検証セットに分割され、臨床検証セットはモデル開発中に使用されませんでした。(表1)。
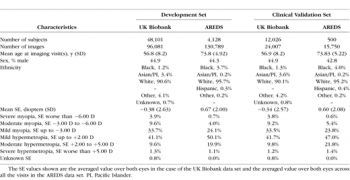
(表1)英国のバイオバンクとAREDSデータセットにおける被験者の人口特性
ディープラーニングを使った網膜眼底画像からの屈折異常予測(2/3)に続きます。
3.ディープラーニングを使った網膜眼底画像からの屈折異常予測(1/3)関連リンク
1)iovs.arvojournals.org
Deep Learning for Predicting Refractive Error From Retinal Fundus Images



コメント