1.AIが何に注目したのかを調べてがんの診断に有効な特徴を発見(2/2)まとめ
・病理医は論文に掲載されたTAFの画像例を用いてこの特徴を学び理解するためのTAFのスコアリング・ガイドラインを作成した
・独立したデータセットにおいてTAFに対するスコアリングが統計的に有意な予後予測値をもたらすことも示せた
・本事例は既存の人間の知識を抽出するためのMLの使用から知識発見のためのツールとしてMLを使用するステップアップとなる
2.AIの発見から人間が学ぶ手法
以下、ai.googleblog.comより「Learning from deep learning: a case study of feature discovery and validation in pathology」の意訳です。元記事は2023年3月14日、Ellery WulczynさんとYun Liuさんによる投稿です。
アイキャッチ画像は病理医のイメージをchatGPT先生に伝えて作って貰ったプロンプトを私が修正してカスタムStable Diffusion先生に作って貰ったイラスト
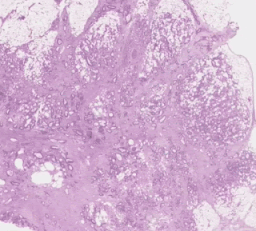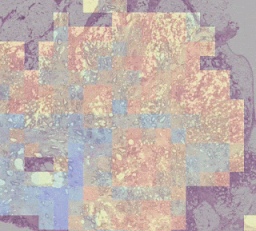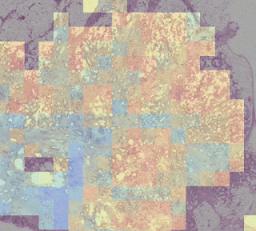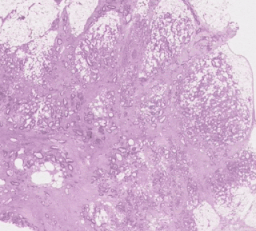
左:H&E病理スライドに「腫瘍脂肪特徴」(TAF:Tumor Adipose Feature)の位置を示すヒートマップを重ねたもの。赤/オレンジでハイライトされた領域は、緑/青でハイライトされた領域や全くハイライトされていない領域と比較して、画像類似性モデルによってTAFの可能性が高いと考えられています。
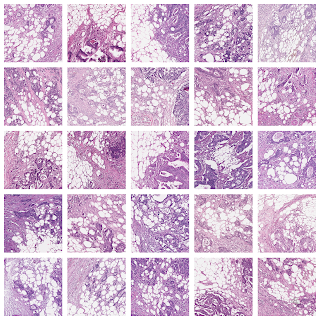
右:複数のケースにまたがるTAFパッチの代表的なコレクション。
モデルが学習した特徴を病理医が使用できることを検証する
これらの研究は、MLモデルが患者の予後を予測する可能性を示す説得力のある例であり、モデル予測に対する洞察を得るための方法論的アプローチでした。しかし、病理医がモデルによって特定された特徴を学習し、予後予測価値を維持したままスコアリングできるかという興味深い疑問が残ったままでした。
最新の論文では、UNIMIBの病理学者と共同で、これらの疑問について調査しました。UNIMIBの病理医は、前回の論文に掲載されたTAFの画像例を用いて、この注目すべき特徴を学び、理解するために、TAFのスコアリング・ガイドラインを作成しました。
TAFが見られない場合は「なし(absent)」と採点し、TAFが見られる場合は「一焦点(unifocal)」「多焦点(multifocal)」「広範囲性(widespread)」のカテゴリーで相対的な量を示すようにしました。
本研究では、病理医が機械学習(ML:Machine Learning)由来のTAFを再現性よく同定できること、また、独立したレトロスペクティブデータセットにおいて、TAFに対するスコアリングが統計的に有意な予後予測値をもたらすことを示しました。これは、MLベースのアプローチによって特定された病理学的特徴を病理医が学習して特定し、スコアリングすることを示した最初の例であると考えられます。
物事を文脈でとらえる:ディープラーニングから学ぶパラダイム
私たちの研究は、人々が「深層学習から学ぶ」例です。
従来のMLでは、モデルは既存の特定の領域知識によって知らされた手作業で設計された特徴から学習します。最近では、深層学習の時代において、大規模なモデルアーキテクチャ、計算機、データセットの組み合わせにより、生データから直接学習することが可能になりましたが、これはしばしば人間の解釈可能性を低下させる事になります。
私たちの研究は、患者の転帰を予測するための深層学習の利用を解釈可能な手法と結びつけ、病理医が適用できる新しい知識を抽出するものです。このプロセスは、医学や科学の問題にMLを適用する進化における自然な次のステップであり、既存の人間の知識を抽出するためのMLの使用から、知識発見のためのツールとしてMLを使用する人々へと移行すると考えています。
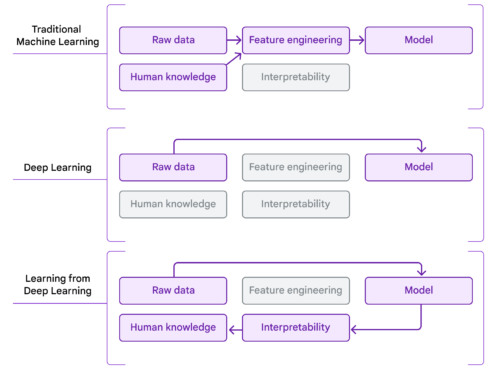
従来のMLは、既存の人間の知識を用いて生データから特徴を工学的に学習することに重点を置いていました。深層学習は、人間の解釈可能性を犠牲にして、モデルが生データから直接特徴を学習することを可能にします。深層学習と解釈可能性手法を組み合わせることで、深層学習から学ぶことで科学的知識のフロンティアを拡大する道が開かれます。
謝辞
共著者のVincenzo L’Imperio、Markus Plass、Heimo Muller、Nicolò’ Tamini、Luca Gianotti、Nicola Zucchini、Robert Reihs、Greg S. Corrado、Dale R. Webster、Lily H. Peng、Po-Hsuan Cameron Chen、Marialuisa Lavitrano、David F. Steiner、Kurt Zatloukal、Fabio Pagniの努力なしではこの研究は成り立たなかったでしょう。
また、Verily Life SciencesとGoogle Healthの病理学チーム、特にTimo Kohlberger、Yunnan Cai、Hongwu Wang、Kunal Nagpal、Craig Mermel、Trissia Brown、Isabelle Flament-Auvigne およびAngela Linからの支援に感謝します。
また、Akinori Mitani、Rory Sayres、Michael Howellからの原稿のフィードバック、Abi Jones氏からのイラストの協力に感謝します。
また、Christian Guelly、Andreas Holzinger、Robert Reihs、Farah Nader、Melissa Moran、Robert Nagle、Biobank Graz、Medical University GrazとGoogleのスライドデジタル化チームの努力、モデル開発中に症例のレビューと注釈を行った病理学者の参加、UNIMIBチームの技術者たちのサポートなくしてはこの仕事は不可能だったでしょう。
3.AIが何に注目したのかを調べてがんの診断に有効な特徴を発見(2/2)関連リンク
1)ai.googleblog.com
Learning from deep learning: a case study of feature discovery and validation in pathology
2)jamanetwork.com
Pathologist Validation of a Machine Learning–Derived Feature for Colon Cancer Risk Stratification